研究内容Research
目標
地球上の99%以上の微生物種は培養法が不明です。それら難培養性微生物種の実態はほとんど未知のままであり、産業利用も困難です。 本郷研では、そうした環境中の難培養性微生物の生理・生態を、16S/18S rRNA遺伝子の分子系統解析や蛍光 in situ ハイブリダイゼーション、さらにメタゲノミクス・1細胞ゲノミクスによる機能推定など、先端的な分子生態学的手法を駆使して研究しています。それによって、
- 微生物群集内での異種間共生、特に真核微生物と細菌との細胞共生機構の解明
- 多様な未知環境微生物種の実態の解明
- 培養不能微生物の1細胞ゲノミクスやメタゲノミクスによる遺伝子資源化
などを目指しています。
研究室の学生には、具体的には、
- シロアリなどの動物腸内に共生する植物質分解性原生生物(単細胞真核生物)と、その原生生物の細胞内・核内・細胞表面に特異的に共生する多様な細菌・アーキア系統群との共生機構・共生進化過程の解明
- 氷河・雪氷環境中の難培養性微生物群集の生理・生態の解明
などの課題に取り組んでいただきます。
シロアリとは
シロアリは植物枯死体のみを餌とする社会性昆虫です。世界に約3,000種が生息し、温帯~熱帯における重要な分解者として、地球の炭素循環に大きく貢献しています。 人間にとっては木材の最重要害虫でもありますが、近年は、木質バイオマス由来の次世代バイオ燃料開発への応用という観点からもよく研究されています。

図1.ヤマトシロアリ
(Reticulitermes speratus)
・ミゾガシラシロアリ科
・日本全国の山地〜平地で普遍的に見られ、大岡山キャンパスにも生息
・Reticulitermes 属シロアリは冷〜暖温帯に広く分布する重要木材害虫
・バーは5mm

図2.イエシロアリ
(Coptotermes formosanus)
・ミゾガシラシロアリ科
・南日本で普遍的に見られ、房総・三浦半島、湘南にも生息
・中国本土原産で、台湾、ハワイ、アメリカ南部などにも分布している
・Coptotermes 属シロアリは暖温帯〜亜熱帯に広く分布する世界的大害虫
・バーは5mm
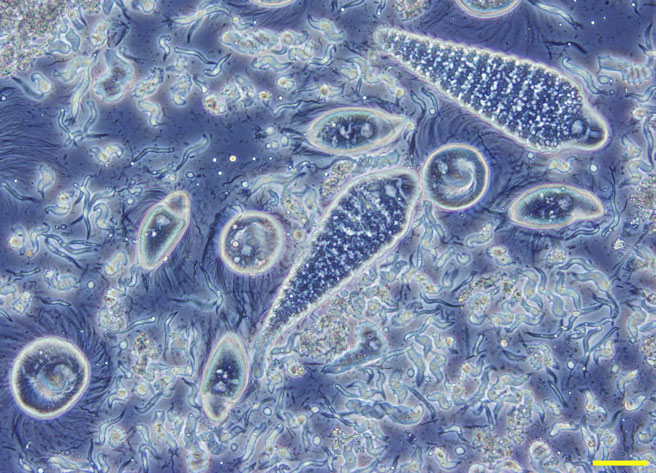
図3.ヤマトシロアリの腸内原生生物群集
・10〜250μmの原生生物(鞭毛虫)が10種類以上共生している
・シロアリとキゴキブリの腸内にのみ生息する特異な系統群を構成している
・酸素に弱い絶対嫌気性で、木質を分解発酵して生きている
・腸内環境に適応しており、培養は困難
・バーは50μm
ところが、シロアリの木質分解と生存に不可欠な役割を果たす腸内微生物群集の大部分は、未だに分離培養に成功しておらず、個々の共生微生物種の分類・生理・生態・相互作用の詳細は不明です。
本研究室では、メタゲノミクスや1細胞ゲノミクスを含めた、培養を介さない分子生態学的手法によって、この腸内共生系の謎に迫ります。
氷河・雪氷微生物とは
何も生存していないように見える氷河にも、実は氷河・雪氷環境に特異的な藻類や細菌が生息しています。 特に、クリオコナイト(cryoconite)と呼ばれる、鉱物片と微生物群集が織りなす褐色の団粒・団塊が見られることも多く、氷河融解との関連で注目されています。 そのクリオコナイト内では多様な微生物種から成る共生関係が営まれており、その構成微生物種には地理的な相違があります。本研究室では、氷河微生物の群集構造と機能を、16S/18S rRNA解析とメタゲノミクスを中心に解明しようとしています。

図4.氷河表面に形成されたクリオコナイト
クリオコナイトは世界各地の氷河上で普遍的にみられますが、その形成には微生物が深く関わっています。 実際に内部には原核生物・藻類・無脊椎動物など多様な微生物が生息しており、まさに氷河内の生物ホットスポットといえます。 一方で、クリオコナイトをはじめとする微生物産生物によって氷河表面の暗色化が進むと、太陽光の吸収量が高まり、氷河の融解が加速するとされています。 このように、生物学・地球科学双方の面から、氷河微生物は興味深い研究対象といえます。
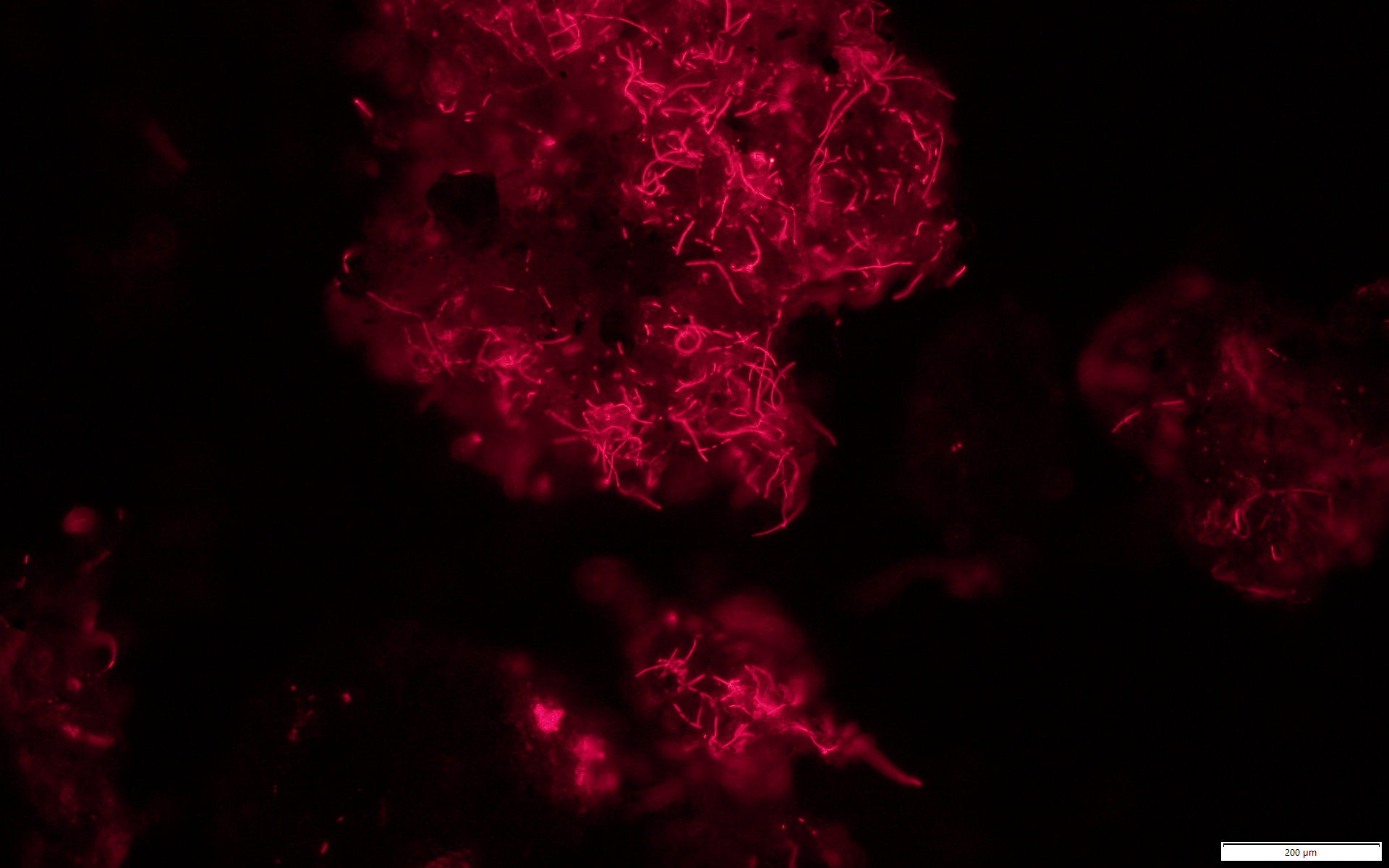
図5.クリオコナイト粒の表面を覆うシアノバクテリアの自家蛍光
クリオコナイトの顆粒構造は多くの場合、糸状シアノバクテリアが絡まり合うことで形成されます。 光合成細菌であるシアノバクテリアは、代表的な一次生産者であるとともにクリオコナイト微生物叢形成の鍵を握る存在といえます。 一方で、クリオコナイトを構成するシアノバクテリアの種類や代謝機能が、地域ごとに大きく異なっていることがメタゲノム解析で明らかになりました (Murakami et al. 2022 Microbiome)。 地域環境を反映した多様なクリオコナイト微生物叢の存在が窺えます。
基本実験・解析技術
small subunit rRNAアンプリコン解析
難培養微生物種が大半を占める環境微生物群集においては、培養法による種多様性解析は無意味です。 現在では、環境中の微生物のsmall subunit rRNA、つまり、細菌・アーキアが対象なら16S rRNA、原生生物や真菌類が対象なら18S rRNA、の遺伝子をPCR法で増幅し、 次世代シーケンサー(Illumina MiSeqなど)で数千から数万本の塩基配列を取得して種の分類・多様性解析を行うのが一般的です。 微生物生態学 / 環境微生物学では、これをアンプリコン(=PCR産物)配列解析と呼んでいます。
FISH(Fluorescence in situ Hybridization)解析
アンプリコン配列解析によって得られたrRNA配列が由来する微生物細胞は、FISH解析によって特定することができます。 標的となるrRNA配列あるいは配列群に特異的に結合する20塩基前後のDNAプローブを設計し、蛍光色素でラベルします。 これとホルマリン固定した微生物群集サンプルを混和し、リボゾームの中のrRNAと特異的に結合させます。それを落射蛍光顕微鏡や共焦点レーザー顕微鏡で観察すれば、標的の細胞だけが光って見えます。
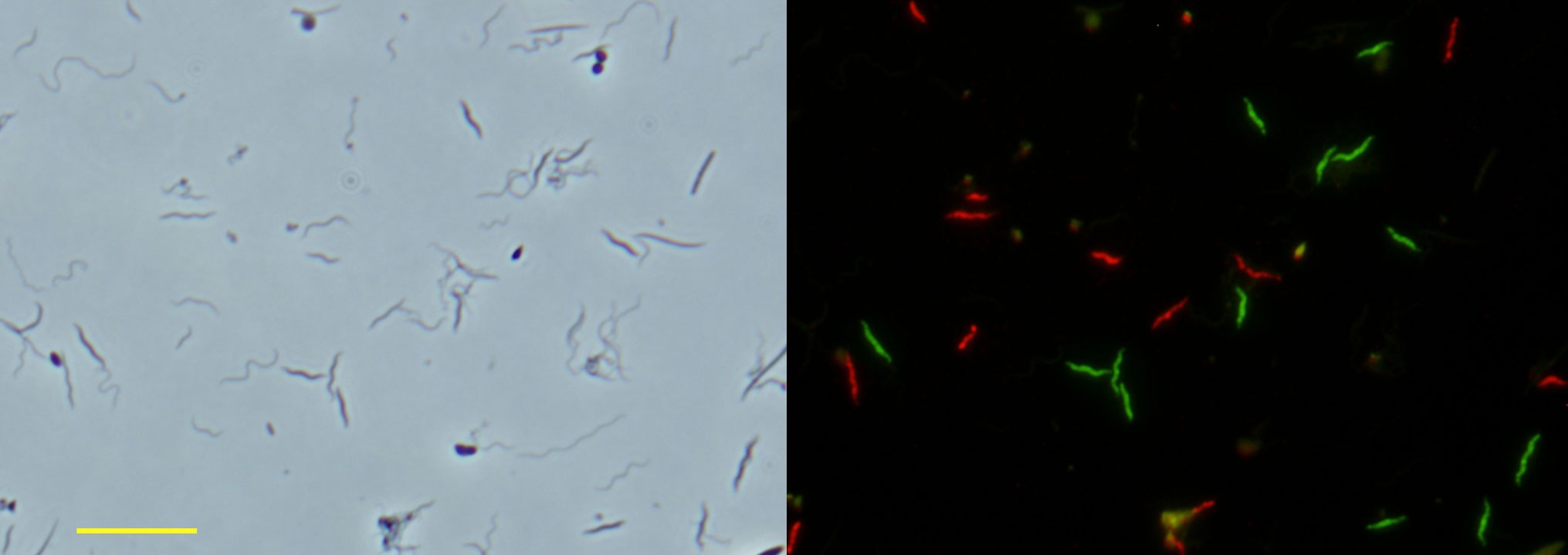
図6.FISH法による未培養細菌群の検出
タカサゴシロアリ後腸液中の細菌群集(図6左、位相差像)に対して、本郷らが新規に発見した系統群であるFibrobacterota門Chitinivibrionales目(旧TG-3)(図6右、緑色)と Fibrobacterota門未培養新目Fibromonadales(図6右、赤色)を特異的に検出しました(Hongoh et al. 2006 Appl Environ Microbiol)。バーは10μm。
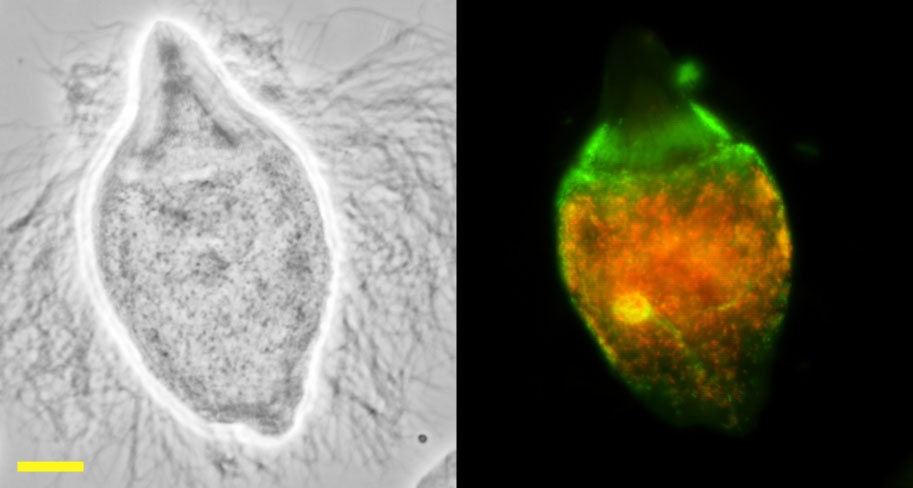
図7.シロアリ腸内原生生物と細胞内共生細菌
ヤマトシロアリ腸内に共生する原生生物Trichonympha agilis(図7左、位相差像)の、さらにその細胞の中に特異的に共生する未培養細菌"Endomicrobiellum trichonymphae" Rs-D17(図7右、橙色)と"Desulfovibrio trichonymphae" Rs-N31(図7右、緑色)。 Rs-D17は細菌新門Elusimicrobiotaに属し、本郷らが初めて全ゲノム解読を行いました(Hongoh et al. 2008 PNAS)。 Rs-N31は必ずRs-D17と同時に共生しており(Sato et al. 2009 Environ Microbiol)、ゲノム解読に成功しています(Kuwahara et al. 2017 ISME J)。このように、一つの原生生物細胞の中や表面には、複数種の細菌が同時共生するのが一般的です。バーは20μm。
メタゲノム解析
環境中の難培養性微生物の機能を調べるには、メタゲノム解析を行なうのが一般的です。これは、群集全体のDNAを数ギガ塩基以上配列解析し、群集全体の機能を遺伝子レベルで網羅的に推定するというものです。群集間の比較もよく行なわれます。 また、コンピューター上で、メタゲノム配列断片を微生物種ごとに分類(ビニング)することで、群集中の優占微生物各種のゲノムを再構築し、種ごとの機能を予測することも可能です。
シングルセル・ゲノム解析
メタゲノミクス+情報学的ビニングによって、各優占細菌種のゲノムを再構築することが可能ですが、ビニング過程で分類マーカーであるrRNA遺伝子や可動因子(プラスミドやウイルスゲノム)が脱落しやすい、という短所があります。 そこで、物理的に1細胞ずつ分取して、Phi29 DNA polymeraseという酵素による多重置換増幅(Multiple Displacement Amplification; MDA)を行い、微生物1細胞ごとのゲノムを解読する手法をシングルセル・ゲノミクスと呼びます。 特に、原生生物細胞共生細菌はクローン細胞が数十〜数千個密集しているため、それを分取して多重置換増幅し、IlluminaとOxford Nanopore Technologiesのシーケンサーで解析することで、完全長のゲノム配列が高確率で取得できます(Hongoh et al. 2008 PNAS; 2008 Science)。
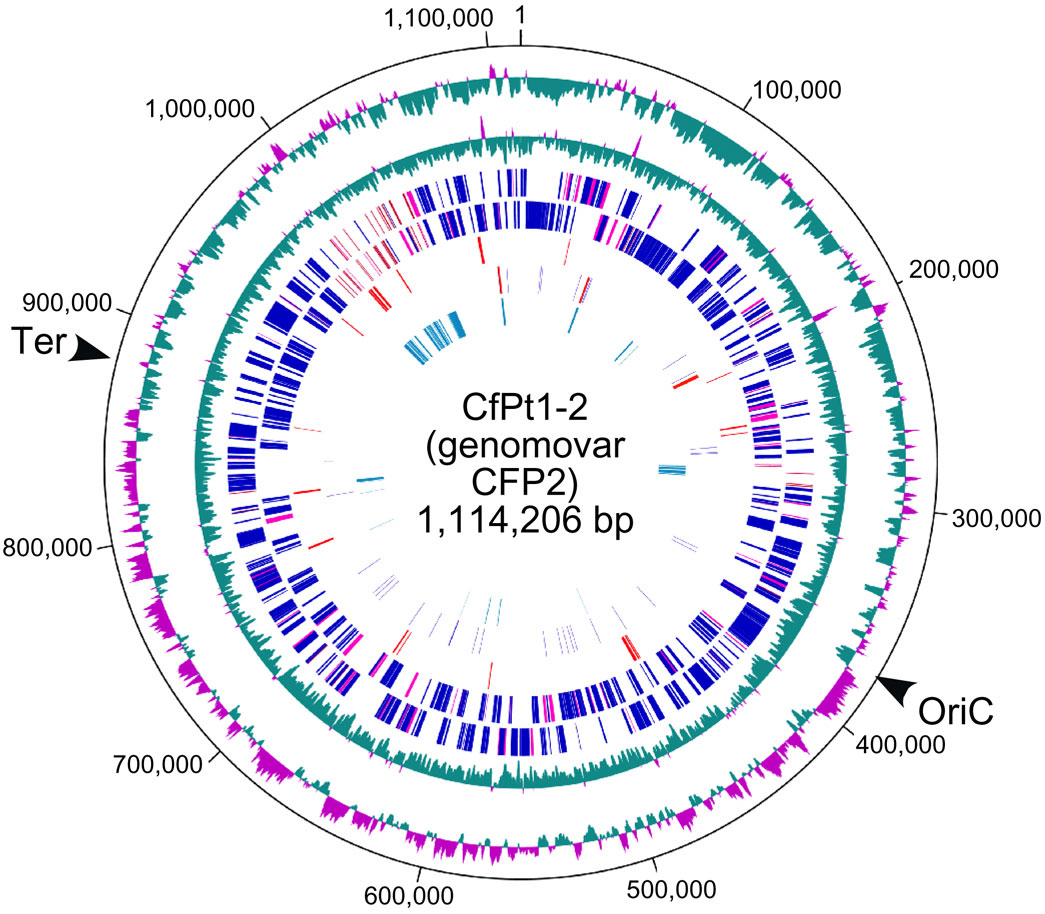
図8.シロアリ腸内原生生物の細胞内共生細菌の環状染色体配列
イエシロアリ腸内に共生する原生生物Pseudotrichonympha grassii 1細胞を単離し、分取した細胞内共生細菌CfPt1-2 ("Candidatus Azobacteroides pseudotrichonymphae"と命名)のゲノムDNAを全ゲノム増幅して塩基配列を取得しました。 その結果、1.1Mbpの環状染色体と3個の環状プラスミドの完全長ゲノム配列の再構築に成功しました(図8)。 培養不能であるCfPt1-2細菌の機能はこれまで全く未知でしたが、配列解析の結果、この原生生物細胞内共生細菌が、空気中の窒素を取込んで核酸、アミノ酸、ビタミン類を合成して原生生物に供給していることを、初めて明らかにしました(Hongoh et al. 2008 Science)。
教育方針 
基本方針
- 生態・進化学 / 分子生物学、フィールドワーク / ラボワーク、ドライ / ウェットなどの境界を超えて、「知りたいこと」の解明のために必要な知識と技術を修得・駆使して、研究に当たることを基本とします。
- 専門分野の知識と技術を修得し、研究が軌道に乗った後は、自ら文献を調べて情報を更新しながら、自らの創意工夫によって研究を展開することが望まれます。
- 指導教員は、学生の研究目標達成のため、適切な指導を行います。
3年次の仮配属(研究プロジェクト2・3)では
- 助教や先輩の研究を手伝いながら、本郷研で使用する基本実験・解析技術(PCR、大腸菌でのクローニング、配列解析、FISH、マイクロマニピュレーション、簡単な情報解析など)を実践的に修得します。
- 週1回のゼミに参加して、研究内容や関連文献を学ぶとともに、自らも英語の文献紹介を担当します。
- この間に、指導教員と相談しながら、特定課題研究のテーマを絞り込みます。早ければ仮配属期間中に、特定課題研究を予備的に開始します。
特定課題研究・特定課題プロジェクトでは
- 1年間(早期卒業希望者は半年)で一定の成果が出るような小テーマを通じて、実験手法や研究推遂行上のルール、文献検索や論文読解術、スライド作成術など、研究を行っていく上での必須の技術・ルールを実践的に身につけます。
- 修士課程進学希望の学生には、多くの場合、3年間で最終的な目標が達成できるような課題を設定します(特課研発表はその中間報告的位置づけ)。
修士課程では
- 修士課程内で終了することを目処に、新規性の高いテーマに取り組みます。研究が軌道に乗った後は、学生自らも積極的にアイデアを出し、研究を発展させていくことが期待されます。
- 研究を遂行する過程で、多くの実践的な知識や技術を吸収します。また、研究内容やその成果を人にわかりやすく伝達することも重要です。研究発表上の技術も修得します。
博士課程では
- 博士課程では、自ら主体的に研究に取り組む姿勢が必須です。指導教員だけではなく、他機関の研究者も含めて、積極的に教えを請い、また議論することが大切です。
- 研究テーマは指導教員と相談の上で決定しますが、最新の実験・解析手法を文献や学会で学んだり、他機関の研究者と交流したりする中で、独自のアイデアを涵養し、研究テーマを発展させていくことが重要です。
- 博士論文を構成するのに十分な質・量の実験・解析データを出すだけではなく、筆頭著者として国際誌に論文を発表しない限り(生命理工学コースでの必要条件)、学位は取得できません。自ら論文の草稿を作成し、指導教員の助言を受けながら修正していく過程で、論文作成技術を修得します。
- 原著論文の作成には、実験・解析とは異なる技術と知識が求められます。研究テーマに関連する過去の文献を網羅的に把握し(それだけ文献を読む必要がある)、データを要領よく図表で示し、論文審査員(2〜3名の他機関の専門家が担当)が納得するデータと精緻な論理構成がなければ、容赦無くrejectされます。つまり、実験・解析・論文作成技術の全てを、国際誌に論文が掲載できる程度には修得できた段階で、初めて博士の学位に値することになります。学位取得には4年以上を要することもあります。
- 研究の遂行には、研究予算の獲得も重要です。日本学術振興会特別研究員や学内の博士支援プログラム(例:SPRING)などのファンドに、積極的にチャレンジしてもらいます。
